

风险较低的医疗器械,如体温计、口罩等。这类产品无需通过FDA审核即可上市销售,但需要注册并获得FDA发放的510(k)号码。
-
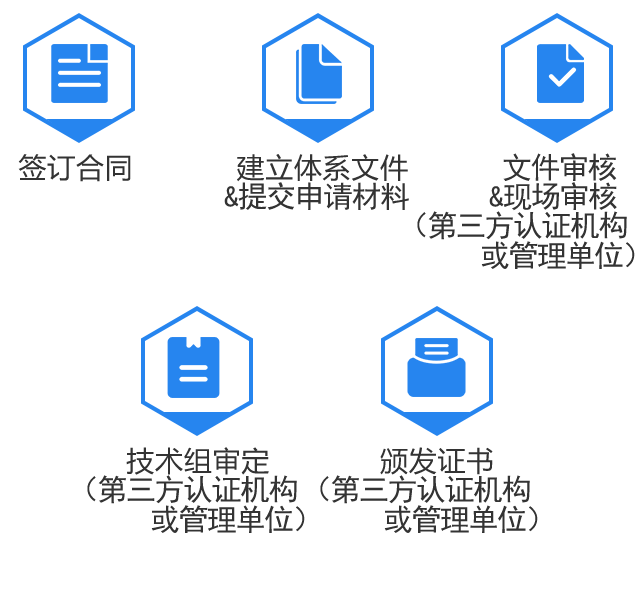
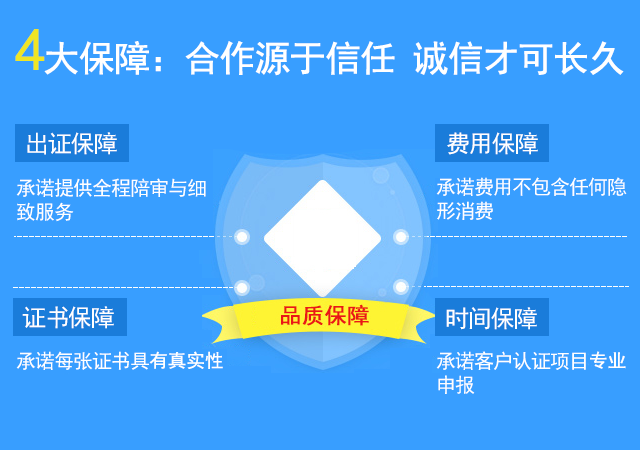
能否确保出证?认证中会有哪些阻碍?
-
价格可信吗?是否存在隐形收费?
-
多久能出证?能否确保及时出证?
-
流程复杂吗?就怕耽误日常工作!
-
FDA注册时需要提交资料
1. 医疗器械注册表格
2. 510(k)预先市场通知或PMA申请表格
3. 包括设备描述、设计原理、性能规格、使用方法等在内的医疗器械技术说明书
4. 医疗器械的标签和包装材料
5. 医疗器械相关测试报告和临床试验数据
-
FDA注册满足技术要求
设计控制:制造商需要建立设计控制程序,确保医疗器械的设计符合FDA要求,并能够满足相关标准和法规的要求。
风险评估:制造商需要对医疗器械进行风险评估,并采取相应的措施来降低风险。
验证和验证:制造商需要对医疗器械进行验证和验证,以确保其性能和安全性符合预期。
临床试验:对于第二类和第三类医疗器械,制造商需要进行临床试验,并提交相应的数据证明其安全性和有效性。
标签和包装:标签和包装必须符合FDA的标准要求,并清楚地说明产品用途、使用方法、警告信息等内容。
生产过程控制:生产过程必须受到有效的控制,并有记录可查,以确保产品质量稳定可靠。
-
特殊医疗器械注册要求
植入式医疗器械:这类产品需要进行长期安全性和有效性测试,并提交相关数据证明其安全可靠。制造商还需要建立追踪系统,监测产品在使用过程中的安全性和有效性。
体外诊断试剂:这类产品需要进行严格的质量控制,确保测试结果准确可靠。制造商需要建立完善的质量管理体系,并提交相关数据证明其准确度和精度。
细胞治疗产品:这类产品需要进行大规模的临床试验,并提交相关数据证明其安全性和有效性。制造商还需要建立完善的生产工艺控制体系,确保产品质量稳定可靠。

亿荣达-认证验厂咨询部辅导老师,是由注册审核员、咨询老师、培训老师,和有机检查员,或农业科技公司、农业大学和种植、养殖、加工专业技术人员和企业质量、生产、技术、检验、管理等人员提供的。
亿荣达服务客户覆盖:黑龙江、吉林、辽宁、内蒙等18个省和自治区。
-

认证顾问
提供前期认证咨询
-

项目跟进
您的全程验证管家
-

咨询师
专业咨询铁军团队
-

售后维护
贴心服务全程安全

 咨询热线 13136680305
咨询热线 13136680305
申诉/售后:0451-58973181 业务合作:18646310958
工作日: 8:20 - 17:20
Copyright © 2024 哈尔滨亿荣达检验技术有限公司
备案号:黑ICP备19006382号






